Химии на клетките
Химии на клетките
Как работят клетките
Галванично действие
В обикновени условия, батериите се разглеждат като електронни помпи. Вътрешната химическа реакция в батерията между електролита и отрицателния метален електрод предизвикват нарастване на свободни електрони, всеки с отрицателен заряд, при отрицателната клема на батерията (-) - анода. Химическата реакция в батерията между електролита и положителния електрод (+) вътре в батерията произвежда излишък от положителни (+) йони (атоми с липсващи електрони, и по този начин с положителен заряд) при положителната (+) клема – катода на батерията. Електрическото налягане (помпа) или потенциална разлика между (+) и (-) клеми се нарича напрежение или електродвижеща сила (EMF).
Различните метали имат различен афинитет за електроните. Когато два различни метала (или метални съединения) са в контакт или са свързани чрез проводима среда, съществува тенденция за електроните да преминават от метала с по-малък афинитет за електроните, които стават положително заредени, към метала с по-голям афинитет, които стават отрицателно заредени. Потенциалната разлика между металите, следователно, ще нараства, докато се балансира тенденцията за пренасяне на електроните между металите. В тази точка "равновесния потенциал" е този, който балансира разликата между склонността да двата метала да получават или отдават електрони.
Една батерия или галванична клетка съхранява енергия в химическа форма в активните си материяали и може да я преобразува в електрическа енергия при поискване, нормално посредством електрохимическа реакция на оксидация-редукция (redox). (Забележете, че общото име "redox" изглежда е било усреднено от скорошен дизайн на течна батерия, използваща две ванадиеви двойки).
Всяка галванична клетка от поне три, а понякога и от четири компонента.
Анода или отрицателния електрод (редуциращия или горивен електрод), който отдава електроди на външната верига и се окислява по време на електрохимичната (разреждане) реакция. Това обикновено е метал или сплав, но водорода също се използва. Анодния процес е оксидацията на метала и образуването на метални йони.
( LEO Губи електрони - Оксидация)
Катода или положителния електрод (окисляващия електрод), който приема електрони от външната верига и се редуцира по време на електрохимичната (разреждане) реакция . Той обикновено е метален окис или сулфид, но кислород също се използва. Катодния процес е редукцията на окис да напусне метала.
(GER Получава електрони - Редукция). Припомнете си мнемониката на лъвското ръмжене.
Електролита (проводника на йони), който осигурява средата за пренасяне на заряда като йони в клетката между анода и катода. Електролитът е типичен разтворител, съдържащ разтворени химически елементи, който осигурява йонна проводимост. Той трябва да бъде не-проводник на електрони, за да се избегне саморазреждането на клетката.
Сепараторът, който електрически изолира положителния и отрицателния електрод.
Процесът Разреждане
Когато батерията е напълно заредена, има излишък на електрони на анода, който дава отрицателен заряд и дефицит на катода, който дава положителен заряд, което води до потенциална разлика през клеткатаl.
Когато веригата е завършена, излишните електрони текат във външната верига от отрицателно заредения анод, който отдава целия си заряд на положително заредения катод, който го приема, неутрализирайки положителния си заряд. Това действие намалява потенциалната разлика на клетката до нула. Веригата е завършена или балансирана от потока на положителни йони в електролита от анода към катода.
Тъй като електроните са отрицателно заредени, електрическия ток, който те представляват, тече в обратната посока, от катода (положителната клема) към анода (отрицателната клема).
Две елетролитни системи
Принципите на Галваничната клетка може да бъдат показани чрез работата на клетката на Даниел посредством две електролитни системи.
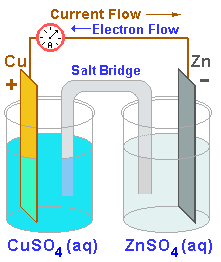
Две електролитни системи на първични клетки са били известни до 1836, когато е била изобретена клетката на Даниел да преодолее проблемите на поляризацията. Това подреждане показва, че има ефективно две полуклетки, в които се извършват химическите реакции. Всеки катод се потапя в различен електролит, с който влиза в реакция. Потенциалът на електрода, положителен или отрицателен, е напрежението, което се създава в един електрод. Електролитите са разделени един от друг с един солен мост или пореста мембрана, който е неутрален и не участва в реакцията. Чрез процеса осмоза, той позволява сулфатните йони да преминат, но блокира металните йони.
Тази схема от два електролита позволява повече степени на свобода или контрол върху химическия процес.
Въпреки, че са по-сложни, тези клетки помагат да бъдат изградени клетки с по-дълъг живот чрез оптимизиране на комбинацията електролит/електрод отделно при всеки електрод.
По-наскоро те са били използвани като основа за Flow Batteries/Течни батерии/, в които електролитите се напомпват през батерията, осигурявайки почти неограничен капацитет.
Цинкът е много популярен аноден материал и химическата реакция по-горе го разтваря в електролита.
За показаната клетка на Даниел може да бъде казано да "изгори цинк и да отложи мед"
Отбележете- Обикновената единична електролитна клетка може също да бъде представена от две полуклетки. Тя може да се разглежда като специален случай на Даниел с два еднакви електролита.
Моделът на клетката като две полуклетки се използва от електрохимиците и проектантите на клетки да изчислят електродните потенциали и да характеризират химическите реакции в клетката. Напрежението на клетката или електродвижещата сила (EMF) за външния ток, получен от една клетка, е разликата в стандартните електродни потенциали на реакциите на двете полуклетки при стандартни условия. Но истинските волтаични клетки ще се различават типично от стандартните условия. Уравнението на Нерст свързва действителното напрежение на химическата клетка към стандартните електродни потенциали, вземайки под внимание температурата и концентрацията на реактивите и продуктите. EMF на клетката ще намалее с намаляването на концентрацията на активните химикали, тъй като те се използват, докато един от химикалите се изтощи напълно.
Теоретичната енергия, която се намира в клетката може да бъде изчислена като се използва уравнението за свободна енергия на Гибс за първоначалното и крайно състояние на равновесие.
За щастие обикновено не се изисква толкова близко познаване на клетъчната химия и термодинамика от страна на механика на приложението на батерията.
Първични клетки
При първичните клетки тази електрохимична реакция е необратима. По време на разреждането химическите съединения се променят трайно и електрическата енергия се освобождава, докато първоначалните съединения се изразходват напълно. Така клетките могат да бъдат използвани само веднъж.
Вторични клетки /акумулатори/
При вторичните клетки тази електрохимична реакция е обратима и първоначалните химически съединения могат да бъдат изградени отново, като се приложи електрически потенциал между електродите, вкарвайки енергия в клетката. Такива клетки могат да бъдат разреждани и зареждани много пъти.
Процесът на зареждането
Зарядното устройство взема електрони от катода, оставяйки го с чист положителен заряд и ги насочва към анода, предавайки му отрицателен заряд. Енергията, вкарана в клетката, връща активните химически вещества в първоначалното им състояние.
Избор на активни химически вещества
Напрежението и тока, генерирани от галваничната клетка, са директно свързани с типа на материалите, които се използват в електродите и електролита.
Склонността на един отделен метал или метално съединение да получава или отдава електрони при взаимодействие с друг материал е известна като потенциал на електрода. Така силите на оксидиране и редуциране са посочени от стандартните потенциали на електродите. Съединения с положителен потенциал на електрода се използват за аноди, а тези с отрицателен потенциал на електрода се използват за катоди. Колкото по-голяма е разликата между потенциалите на електродите на анода и катода, толкова по-голяма е EMF на клетката и по-голямо е количеството енергия, което може да бъде произведено от клетката.
Електрохимичен ред е списък или таблица от метални елементи или йони, подредени според техните електродни потенциали. Редът показва тенденцията на един метал да редуцира йоните на друг метал под него в реда.
Автора на статията е Woodbank Communications Ltd - консултантска фирма, осигуряваща обучение за батерии и системи за управление на батерии за електрически транспортни средства, както и за приложения със съхранение на енергия с голям капацитет.

